Die Entwicklung der Coronaimpfstoffe zeigt, wie schnell Krankheitserreger gebändigt werden können, wenn die Voraussetzungen stimmen. Dass es nicht immer so einfach ist, zeigt der anfangs vielversprechende HIV-Impfstoff von Johnson & Johnson
Das humane Immundefizienz Virus (HIV) entwickelte sich mit Beginn der achtziger Jahre zu einer Pandemie, die bis heute nicht unter Kontrolle gebracht werden konnte. Auch wenn sich seit der Entdeckung des Virus 1983 durch die Nobelpreisträger Françoise Barré-Sinoussi und Luc Montagnier viele Behandlungsmöglichkeiten ergeben haben, die Patienten ein fast normales Leben ermöglichen, scheitert die Prävention der Krankheit durch einen HIV-Impfstoff regelmäßig.
Der Grund dafür liegt in den drei großen Problemen, die sich durch den Aufbau des HI-Virus ergeben und nachfolgend erörtert werden:
Die Wirtszelle
In der Biologie herrscht Uneinigkeit darüber, ob Viren lebendige Organsimen sind. Im Gegensatz zu klassischen, lebendigen Organismen verfügen Viren über keine Möglichkeit, sich selbstständig zu replizieren. Für ihre Vermehrung müssen sie eine Zelle befallen und die dort enthaltenen Zellbestandteile (sogenannte Organellen) übernehmen. Schematisch funktioniert dies wie in der folgenden Grafik dargestellt. Die Viren betreten die Wirtszelle eingeschnürt in die Zellmembran der Zelle. Im inneren wird das Erbgut freigelegt und die Organellen werden übernommen. Das virale Erbgut wird vermehrt, zum fertigen Virus kombiniert und aus der Zelle geschleust. Meist unter Zerstörung der Wirtszelle.
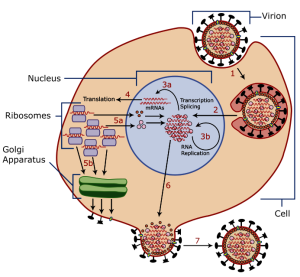
Wie die Vermehrung des viralen Erbguts genau erfolgt, hängt von der Virusfamilie ab. Coronaviren können ihre RNA beispielsweise direkt in der Zelle zu Proteinen umbauen lassen, und brauchen keine Extraschritte für die Proteinproduktion. Anders verhält es sich mit HIV. HI-Viren sind sogenannte Retroviren, sie müssen also vor ihrer Aktivierung von RNA in DNA umgeschrieben werden, die anschließend in die DNA der Wirtszelle eingebaut werden. Die Zelle produziert also über ihre gesamte Lebensdauer die Proteine des Virus und gibt das virale Erbgut bei der Zellteilung an ihre Tochterzellen weiter.
Für gewöhnlich kann das Immunsystem Veränderungen der Wirtszelle anhand der Oberfläche detektieren und die Zellen so ausschalten. Bei einer HIV-Infektion nutzt das Virus allerdings die Zellen des Immunsystems, die T-Helferzellen, Makrophagen (Fresszellen), sowie die dendritischen Zellen, die u.a. eindringende Krankheitserreger erkennen und zu den Lymphknoten bringen.
All diese Zellen besitzen ein gemeinsames Oberflächenprotein, namens CD4. Diese Proteine werden von den Immunzellen benötigt, um Krankheitserreger zu erkennen, die noch keine Zelle infiziert haben, also frei im extrazellulären Raum schwimmen. Immunzellen wie dendritische Zellen oder B-Zellen können Antigene, also körperfremde Stoffe die z.B. aus Viren oder Bakterien stammen, erkennen und auf ihrer Zelloberfläche präsentieren. Die Präsentation erfolgt auf einem Protein namens major histocompatibility complex 2 (MHC-2). Für die einwandfreie Funktion unseres Immunsystems ist es also wichtig, dass Immunzellen körperfremde Stoffe erkennen, über den MHC-2-Komplex anderen Immunzellen präsentieren und diese die Antigene über CD4-Proteine erkennen können. Und genau hier setzt das HI-Virus an.
HIV nutzt zum Eindringen in die Zelle genau diese CD4-Proteine. Dafür ist HIV seinerseits extra mit zwei Proteinen ausgestattet, gp120 und gp41. Die Bindung an CD4 verändert die Konformation, also die Struktur von gp120, sodass es jetzt noch an ein weiteres Oberflächenprotein, einen Corezeptor auf der Wirtszelle binden kann. Diese Corezeptoren kommen natürlich in besonderem Maße auf T-Zellen, Makrophagen und dendritischen Zellen vor. Nachdem nun gp120 an die zwei entscheidenden Proteine auf der Zelloberfläche gebunden hat, kann sich gp41 entfalten und die Fusion von HIV mit der Wirtszelle ermöglichen. Im inneren der Zelle kann HIV sein Erbgut in DNA umschreiben und in das Erbgut der Wirtszelle einbauen. Die nötigen Enzyme, Reverse Transkriptase und Integrase, hat das HI-Virus direkt dabei.
Zu Beginn der Infektion sind noch genügend gesunde Immunzellen vorhanden, die infizierte Zellen erkennen und bekämpfen können. Doch diese Immunantwort lässt mit der Zeit nach. Mit jeder T-Zelle, die ihre Viren freisetzt, werden mehr Zellen infiziert, die aber nur zum Teil vom Immunsystem bekämpft werden. Denn das HI-Virus reduziert die Bildung von CD4- und MHC-2-Rezeptoren auf infizierten Zellen, sodass die Wahrscheinlichkeit sinkt, dass infizierte Zellen vom gesunden Teil des Immunsystems erkannt werden. Verantwortlich dafür ist das Protein Negativer Regulationsfaktor (Nef), das ebenfalls von HIV mitgebracht wird.
HIV überwältigt also die Fundamente unseres Immunsystems, ohne die auch keine erfolgreiche Impfung möglich ist. Aber das größere Problem kommt erst noch.
Die Mutationsrate
Um im Körper aktiv zu bleiben, muss HIV sein Erbgut in die DNA der Zelle integrieren. Dieser Vorgang passiert nicht einfach so, sondern wird durch das Enzym reverse Transkriptase katalysiert. Um dann aus der DNA irgendwann wieder RNA zu machen, die schließlich zu Proteinen wird, ist die RNA-Polymerase nötig, die in all unseren Zellen ihre Arbeit verrichtet. Beide Enzyme arbeiten also mit Erbgut, aber das nicht sonderlich gründlich. Wann immer sie mit einer solchen Nukleinsäure (eine Sammelbezeichnung für DNA oder RNA) zu tun haben, bauen sie Fehler ein und das Erbgut mutiert.
Die Wahrscheinlichkeit für einen solchen Fehler ist mit einer Wahrscheinlichkeit von 1:1000 relativ gering, aber bei der hohen Replikationsrate von HIV, das pro Tag etwa 1 Milliarde Kopien von sich erzeugt, häufen sich die Fehler sehr schnell. Da die Hälfte aller HI-Viren im Körper bereits nach etwa zwei Tagen ersetzt wurde, findet sich nach etwa 8 Wochen kein Virus des ursprünglichen Wildtyps mehr im Körper der Patienten. Sie alle weisen Mutationen auf, die im Körper während der Vermehrung entstanden sind.
Diese extreme Mutationsrate macht die Entwicklung eines wirksamen Medikaments fast unmöglich. Die Tatsache, dass trotzdem wirksame Präparate zur Reduzierung der Virenlast im Körper existieren, verdanken wir Kombipräparaten, die mehrere Wirkstoffe in sich vereinen. Beispielsweise besteht das HIV-Medikament Stribild aus 4 verschiedenen Wirkstoffen:
Emtricitabin hemmt die Arbeit der reversen Transkriptase.
Tenofovir ist ebenfalls ein Hemmer der reversen Transkriptase und kann sich in die DNA befallener Zellen einbauen.
Cobicistat verhindert den Abbau der Wirkstoffe und verlängert so die Wirksamkeit der Medikamente.
Elvitegravir hemmt das Enzym Integrase, das die umgeschriebene HIV-DNA in das Erbgut der Wirtszelle einbaut.
Trotz der hohen Mutationsrate von HIV ist die Wahrscheinlichkeit, dass ein Virusmolekül genau die Mutationen aufweist, die die Wirkung aller drei Inhaltsstoffe dieses Medikaments, oder – was noch unwahrscheinlicher ist – die Wirkung der anderen, zugelassenen Medikamente blockiert, quasi 0. Die Behandlung von HIV benötigt also eine Kombination verschiedener Wirkstoffe.
Unser Immunsystem kann leider nicht ohne weiteres in infizierte Zellen hineinschauen und beobachten, ob bestimmte Proteine in der Zelle aktiv sind, die man von HIV kennt. Die Möglichkeiten zur Erkennung von HIV sind somit auf die Oberfläche der viralen und infizierten Zellen beschränkt. Dadurch ist die Wahrscheinlichkeit, einer Erkennung durch das Immunsystem zu entgehen, um ein Vielfaches größer. Ein potenzieller HIV-Impfstoff muss dieses Problem lösen.
Die Idee des Impfstoffes von Johnson & Johnson orientiert sich also an dem Schema, das bei der Medikamentenentwicklung angewandt wurde. Dazu gleich mehr, denn es gibt noch einen weiteren Punkt, der die Entwicklung von HIV-Impfstoffen so sehr erschwert.
HIV befällt nur Menschen
Die Hürden für Medikamententests am Menschen sind hoch. Wie bereits im Beitrag über die nötigen Zulassungsstudien für Impfstoffen beschrieben, sind vor den Tests am Menschen versuche an Tiermodellen vorgeschrieben. Das große Problem bei diesen Tiermodellen ist, dass HIV ausschließlich Menschen befällt. HIV ist ein enger verwandter des simianen Immundefizienz-Virus (SIV), das Affen befällt und vermutlich bei vier voneinander unabhängigen Gelegenheiten vom Affen auf den Menschen übergesprungen ist und sich dort als HIV etabliert hat. Bestärkt wird diese Annahme dadurch, dass es vier verschiedene HIV-Stämme gibt (M, N, O und P), die auf verschiedenen Übertragungswegen auf den Menschen übergesprungen sind. Und auch wenn die unterschiedlichen Stämme nicht zu gleichen Teilen in der Bevölkerung zirkulieren, muss ein HIV-Impfstoff diese Variabilität berücksichtigen.
Auch wenn HIV und SIV also eine genetische Verwandtschaft besitzen, sind es dennoch unterschiedliche Viren und die Ergebnisse der Forschung an SIV können nicht ohne weiteres auf HIV übertragen werden. Neben der Erforschung von Wirkstoffen gegen HIV ist es also auch nötig, Modelle zu entwickeln, mit denen man HIV-Therapien im Tierversuch untersuchen kann. Eines dieser Modelle besteht beispielsweise in einem HIV/SIV-Hybriden, der eine teilweise Sensitivität für HIV-Medikamente besitzt, aber an Affen getestet wird. Aber auch dieser Hybrid garantiert nicht die Wirksamkeit eines HIV-Impfstoff.
Während man die Wirksamkeit von Medikamenten darüber messen kann, wie nachhaltig sie die Zahl der HI-Viren im Körper verringern, müssen Impfstoffe, die präventiv wirksam sind, für den Wirksamkeitsnachweis andere Wege gehen.
Für gewöhnliche, impfpräventable Krankheiten, genügt z.B. die Messung der Antikörperlevel, um eine gewisse Korrelation zwischen ihrer Anzahl und dem Schutz vor der Erkrankung zeigen zu können. Da die natürlichen Antikörper gegen HIV offensichtlich nicht ausreichen, um eine verlässliche Immunität gegen das Virus zu erzeugen, kann ein HIV-Impfstoff nicht nur anhand der Antikörper gemessen werden. Hinweise darauf, welche Komponenten des Immunsystems auf welche Weise stimuliert werden müssen, um vor einer HIV-Infektion zu schützen, werden in Studien nur ausgesprochen mühsam gefunden.
HIV-Impfstoff: Imbokodo-Studie zeigt nur 25% Wirkung
All diese Faktoren erschweren die Arbeit an wirksamen Medikamenten und machen die Entwicklung eines Impfstoffes noch komplizierter. Trotzdem kam die Meldung von Johnson & Johnson, dass ihr HIV-Impfstoff in der Phase-2b-Studie gescheitert ist, überraschend.
Die Eckdaten lauteten folgendermaßen: Seit November 2017 wurden in der Imbokodo genannten Studie über 1.5 Jahre etwa 2600 Frauen aus 5 Ländern südlich der Sahara mit dem J&J HIV-Impfstoff geimpft. In diesem Testzeitraum infizierten sich 63 Frauen der Kontrollgruppe und 51 Frauen in der Gruppe der geimpften. Das entspricht einer Wirksamkeit von 25.2%.
Dabei klang die Zusammensetzung des Impfstoffes mit dem sperrigen Namen Ad26.Mos.HIV auf den ersten Blick sehr intelligent. J&J beschreiben ihren Impfstoff als Mosaik-Impfstoff, der, wie der Name schon sagt, aus einem Mosaik verschiedener HIV-Gene zusammengestellt wurde.
Hier setzt das Unternehmen auf eine etablierte Technologie. Für den Transport der HIV-Moleküle nutzt das Unternehmen ein Adenovirus als Vektor. Genau das Virus, das auch im Corona-Impfstoff von J&J Verwendung findet.
In das Genom des Adenovirus – das so verändert wurde, dass es sich im Körper nicht vermehren kann – wurden die Anleitungen zum Bau verschiedener, spezifischer HIV-Proteine eingebaut. Das Env-Gen kodiert für die virale Hülle und ist verantwortlich für die Ausbildung der gp-Proteine, mit denen das Virus die Zelle befallen kann. Das gruppenspezifische Antigen (gag) kodiert für eine reihe wichtiger Proteine, aber vor allem für das Nukleokapsid p24, mit der die HIV-RNA im inneren der Wirtszelle vor dem Abbau geschützt wird. Die oben erwähnten Enzyme reverse Transkriptase und Integrase werden von einem Genabschnitt namens Polymerase (pol) gebildet, der ebenfalls in das Adenovirusgenom integriert wurde.
Mit dieser Zusammenstellung an viraler RNA sind die befallenen Zellen dazu in der Lage, die klassischen HIV-Proteine auf der Zelloberfläche von gewöhnlichen Körperzellen zu produzieren, auf die das Immunsystem reagieren kann. In Phase 2a der Studie wurden folgende Impfstoffkombinationen getestet:
In dieser randomisierten, doppelt verblindeten, placebokontrollierten Studie wurde die Impfgruppe mit dem Ad26.Mos.HIV geimpft. Nach 24 und 48 Wochen wurde den Probanden eine Boosterimpfung mit einem von drei möglichen Boostern oder dem Placebo (nur in der Kontrollgruppe) verpasst: Ein Teil der Probanden bekam eine hohe Dosis des puren gp140-Proteins, aus dem die Proteine gp120 und gp41 geschnitten werden. Ein anderer Teil bekam eine zweite Dosis des Ad26.Mos.HIV Impfstoffes, entweder mit oder ohne Zusatz einer hohen Dosis gp140.
Der letzte Teil der Probanden bekam eine Auffrischung mit einem anderen Virus, dem Modified-Vaccinia-Ankara-Virus. Hierbei handelt es sich um ein abgeschwächtes Kuhpockenvirus, das früher zur Ausrottung der Pocken verwendet wurde. Das Virus wurde genau so bearbeitet, wie es beim Adenovirus der Fall ist und eignet sich deshalb besonders gut für die Anwendung als Impfvirus, weil es im Zuge seiner Züchtung in Hühnerfibroblasten die Gene verloren hat, die für eine Replikation in Säugetierzellen verantwortlich sind. Auch dieser MVA-Impfstoff wurde entweder mit oder ohne gp140 verabreicht.
In dieser Phase-2a-Studie zeigte sich, dass der Einsatz des Adenovirus, sowohl für die erste, als auch die zweite Impfung die besten immunologischen Ergebnisse erzielte. Daher wurde dieser Ansatz als Grundlage der Imbokodo-Studie verwendet. Mit geringem Erfolg, wie sich nun zeigte.
Bei Johnson & Johnson hat man allerdings die Hoffnung auf einen wirksamen HIV-Impfstoff noch nicht ganz aufgegeben. Auf der Unternehmenswebsite ließt man neben der Hiobsbotschaft auch folgendes:
In parallel to the Phase 2b Imbokodo HIV vaccine trial, Janssen is sponsoring the ongoing Phase 3 Mosaico study (HVTN 706/HPX3002) which is testing the safety and efficacy of a different composition of the HIV vaccine regimen among men who have sex with men (MSM) and transgender individuals. This study is being conducted in the Americas and Europe where different strains of HIV are circulating. Given these differentiating factors and following consultations with the Mosaico study independent Data and Safety Monitoring Board (DSMB), it was decided that the Mosaico study will continue at this time.
Zusammengefasst möchte man einen anderen HIV-Impfstoff für homosexuelle Männer, der gegen andere als die in Afrika heimischen HIV-Stämme wirken soll, in Amerika und Europa testen. Diese Studie begann 2019 und soll noch bis 2024 laufen. Bleibt zu hoffen, dass für diesen HIV-Impfstoff eine bessere Wirksamkeit erzielt werden kann.


[…] Omicron, zu dem man nur Vermutungen anstellen kann. Ob sich das Virus in einem immungeschwächten HIV-Patienten entwickelt hat, ob es zu einer Kreuzinfektion mit mehreren Corona-Varianten kam oder ob vielleicht […]
[…] der T-Zell-Aktivität verbunden. Aber das ist auch schon die einzige Gemeinsamkeit. Wie bereits im Beitrag über die HIV-Impfung beschrieben, setzen sich HI-Viren in Immunzellen fest, vermehren sich dort und befallen weitere Zellen, bis […]